|
| ||||||
| |||||||
| / Каталог / Клеточные технологии и технологии для работы с клетками / Сортировка клеток | |||||||||||||||
Клеточный сортер MoFloMoFlo - высокопроизводительный сортер клеток
MoFlo® - это высокопроизводительный сортер, на основе модульной платформы, сконфигурированной под каждого пользователя. Прибор не имеет аналогов по своим техническим характеристикам, точности измерения, многофункциональности, надежности и скорости работы. MoFlo обеспечивает решение любых задач по сортировке клеток - скорость сортировки составляет более 70000 клеток в секунду с одновременным измерением 32 параметров и чистотой выхода более 99%. ХарактеристикаMoFlo® произвел переворот в проточной цитометрии, как прибор, отвечающий наиболее требовательным стандартам по техническим характеристикам. Созданный прежде всего как высокоскоростной сортер, MoFlo® позволяет сортировать клетки со скоростью более 70 000 клеток в секунду. Дополнительно, MoFlo® имеет 32 параметра, чистота сортировки более 99% с превосходной жизнеспособностью; запатентованная и проверенная система сортировки в 4 пробирки одновременно (4 WayTM Sort). MoFlo® является инструментом выбора при анализе переноса энергии флуоресцентного резонанса, работе с флуоресценцией протеинов, обнаружении бактериофага и других задач. Будучи золотым стандартом в проточной цитометрии, MoFlo® имеет широкий спектр приложений в области биологии, включая исследование органелл, антигенов, рецепторов, цитокинов и энзимов; измерение передачи сигнала, апоптоза, потока кальция и мембранного потенциала; а также сортировка спермы, стволовых клеток и других минорных популяций. МодульностьCytomation сохранил модульный дизайн MoFlo®, впервые разработанный в Lawrence Livermore National Laboratory. Модульная структура и возможность усовершенствования позволяет легко приспосабливать MoFlo® к новым технологиям и потребностям лаборатории. Электроника"Сердцем" электронной системы MoFlo® является запатентованная параллельная обработка данных. С использованием этой уникальной технологии MoFlo® проводит измерение и сортирует каждую клетку, проходящую последовательно через пространственно разделенные лазерные лучи. Одновременно обрабатывая данные, MoFlo® объединяет аналоговую обработку импульса и цифровую компенсацию для достижения высокоскоростного мультицветного анализа и сортировки. MoFlo® предлагает запатентованную систему сортировки Contempo™, использующую комплекс алгоритмов для обработки более миллиарда цифровых команд в секунду и обеспечивает 8х8 внутри/межлазерную компенсацию в режиме реального времени. Поэтому пользователь может самостоятельно выбирать число каналов, уровень переключения, коэффициент усиления и другие функции. ОптикаИспользуя только высококачественные оптические элементы для лазерных и микроскопических исследований, оптическая система MoFlo® соответствует предъявляемым требованиям к производительности и модульности. На MoFlo®, поддерживающем до 3 источников возбуждения (лазеров), можно разместить фактически любой коммерчески доступный лазер. Независимые, пространственно разделенные лазерные лучи, делают их регулировку простой, тогда как высокие требования к цифровой апертуре и волнозависимые специальные материалы и покрытие улучшают качество сигнала. Стандартная оптическая скамья уменьшает помехи и стабильна в работе, с возможностью расширения для неограниченного числа стандартных заменяемых спектральных фильтров. Технологически уникальные тройные микропоры обеспечивают пространственную фильтрацию, что увеличивает соотношение сигнал/шум и уменьшает межлазерные перекрестные помехи. Пользователь может выбирать из обширного списка стандартных спектральных фильтров и фотоэлектронных умножителей, которые позволяют улучшить красную чувствительность спектра и часто используются вместе с точным фотодиодом для детекции переднего светорассеивания. Фильтры также можно заказать дополнительно. MoFlo® сохранил вертикальную световую поляризацию для спектральных приложений, таких как анизотропия. Есть возможность установки двух инфракрасных камер. Первая камера показывает поток, идущий от CytoNozzle™; а вторая установлена в регионе сортировки. Таким образом, MoFlo® является практически открытой системой, позволяющей пользователю самостоятельно решать вопрос о видах применяемых лазеров и оптических фильтров. А самостоятельная замена оптических фильтров экономит время и финансы, так как нет необходимости привлечения к этой процедуре сервисного инженера. Проточная система
CytoNozzle™ является основой проточной системы MoFlo® и предназначена для работы в широком диапазоне низкого и высокого давления и разной скорости потока со стабильным минимальным резонансным эффектом. При различных уровнях давления сохраняется превосходная жизнеспособность клеток. Для использования различных приложений сортировки, Cytomation предлагает широкий спектр взаимозаменяемых керамических наконечников для насадок разных размеров от 50мкм до 200мкм. Все компоненты системы (соединительные трубочки, коннекторы, клапаны) имеют минимальный "мертвый" объем, стабильные физические характеристики, высокую устойчивость к реагентам и цветное кодирование для безопасности и простоты использования. Забор материала осуществляется через несколько механизмов, в зависимости от спецификации лаборатории и используемого приложения. Блок для ручной подачи пробирок прост в управлении, с возможностью регулирования скорости потока и кинетическим переносом реагентов, тогда как Автоматическая станция имеет 3 скорости перемешивания материала и повышенный уровень биологической защиты. Обе системы минимизируют возможность смешивания материала, их просто демонтировать для автоклавирования, стерилизации и/или замены и имеют систему циркуляции воды для контроля температуры. Новая разработка Cytomation - система автозабора MoSkeeto™ обеспечивает быструю подачу материала из плашек с различным количеством лунок. 4 Way Sort System
Система одновременной сортировки в 4-х направлениях (4 Way Sort System) увеличивает возможность стандартной сортировки в 2-х направлениях в клеточном сортере MoFlo до сортировки в 3-х и 4-х направлениях. Это означает, что пользователь может сортировать быстрее и терять меньше клеток, чем это было ранее.
БезопасностьMoFlo® установил новые индустриальные стандарты для безопасности оператора и сохранности материала. Оптические элементы доступны без удаления или поломки защитного покрытия. Защитная дверца на передней панели обеспечивает стандартную пассивную защиту, требования к которой установлены Международным Обществом Аналитической Цитологии. Открытая архитектура позволяет проводить тщательную процедуру чистки всего инструмента. Система CytoNozzle™ и сортировочный блок легко снимаются для автоклавирования. Возможная автоматизация системы забора материала сводит к минимуму контакт оператора с исследуемым материалом, тогда как система CytoShield™ устанавливает защиту экстракласса: пользовательский защитный шкаф, фильтры, дистанционное управление, система предупреждений и автоматического отключения, блок деконтаминации формальдегида. Простота стерилизации и деконтаминации элементов прибора обеспечивает качественные результаты работы, упрощает проведение экспериментов с требованиями соблюдения стерильности; сокращает время подготовки к работе анализатора в стерильных условиях. АвтоматизацияЯвляясь пионером в области проточной цитометрии, Cytomation предоставляет беспрецедентные возможности по автоматизации своих сортеров. Доступны в настоящее время несколько автоматических модулей. MoSkeeto™ обеспечивает забор материала из многолуночных плашек. CyCLONE может вносить каждую клетку в отдельные ячейки плашки. CytoBorg™ - автоматическая система переноса плашек - перемещает плашки между камерой сортировки и инкубатором или другой установкой для хранения материала. SortMaster™ контролирует разделение капли и корректирует и/или прерывает сортировку в случае возникновения проблем. Все эти автоматические элементы запрограммированы и управляются с помощью программного обеспечения Summit™. Представленные возможности автоматизации значительно расширяют и упрощают области применения сортера, сокращают время анализа, обеспечивают большую безопасность исследуемого материала и продуктов сортировки.
Использование сортера MoFloВведение
Очищенные популяции стволовых клеток представляют большой интерес для медико-биологического сообщества в двух аспектах - фундаментальном (исследование биологии стволовых клеток) и прикладном (клиническая трансплантация). В настоящее время продолжаются исследования гематопоэтических и негематопоэтических стволовых клеток с целью уточнения маркеров поверхности, функциональных характеристик и способности приживляться в организме реципиента in vivo. Ранее получение плюрипотентных клеток в лабораторных условиях представляло собой весьма сложную задачу. Например, при выделении периферических стволовых клеток для трансплантации из крови стимулированного донора их количество составляет от 0.01% до 1% лейкоцитов; содержание в костном мозге несколько выше - 0.5-5%. Для очистки этих клеток было разработано несколько подходов, в том числе высокоэффективная сортировка на основе мультипараметрического иммунофенотипирования или иммунофенотипирование в сочетании с функциональными тестами. Высокопроизводительный сортер клеток MoFlo оказался неоценимым помощником в этой работе. Эксперименты, описанные ниже, показывают, как MoFlo позволяет очистить минорную популяцию клеток костного мозга. Материал и методы
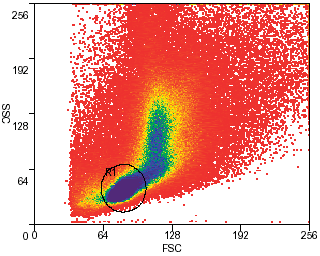
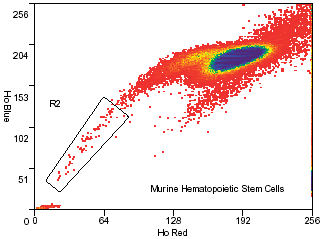
Окраска. Костный мозг из большеберцовой и бедренной костей мышей (линия C57BL/6, возраст 5-8 недель) помещают в полипропиленовые центрифужные пробирки и заливают раствором Хэнкса (HBSS+). Подсчитывают число ядросодержащих клеток в полученной суспензии, затем осаждают клетки и ресуспендируют в подогретой минимальной среде Дульбекко (DMEM+) в концентрации 106/мл. Добавляют краситель Hoechst 33342 (Sigma) до конечной концентрации 5 мкг/мл. Суспензию хорошо перемешивают и оставляют на 90 мин в водяной бане при постоянной температуре 37°С. Сразу по завершении инкубации пробирки переносят в охлажденную (4°С) центрифугу, осаждают, ресуспендируют в охлажденном HBSS+ и далее хранят при 4°С. Если перед исследователем стоит задача пометить поверхность клеток антителами, суспензию следует хранить при 4°С. При желании на этом этапе можно добавить в суспензию пропидий йодид (2 мкг/мл) для исключения из сортировки нежизнеспособных клеток. Настройка прибора. Используется ультрафиолетовый лазер (351 нм). Эмиссию флуоресценции детектируют в синем и красном диапазоне (используя фильтры 450/20 и 650 eFLP соответственно). Проточная цитометрия. Окрашеные клетки загружаются в MoFlo. При помощи программного обеспечения Summit, по отношению прямого и бокового рассеяния идентифицируется основная клеточная популяция (Рис. 1). Затем по отношению синей и красной флуоресценции красителя Hoechst 33342 идентифицируется минорная популяция клеток-предшественников (Рис. 2). Обсуждение результатовИспользование MoFlo превратило очистку популяций гематопоэтических и негематопоэтических стволовых клеток (в том числе - минорных) в рутинную процедуру. Новые решения (электороника, оптика и гидравлика), реализованные в конструкции MoFlo, обеспечивают мощность и точность, необходимые для работы с редкими событиями, и позволяют получить искомые субпопуляции с высоким выходом. Кроме того, запатентованная конфигурация наконечников, использованных в MoFlo, уменьшает турбулентность и минимизирует отрицательные воздействия ускорения на клетки. В результате очищенные клетки полностью сохраняют функциональные свойства, что делает возможным их приживление in vivo, в том числе после трансплантации, и долгосрочное культивирование.
Исследование жизнеспособности и функциональной активности клеток при высокоскоростной сортировке на сортере MoFloВведениеНепрерывная сортировка клеток при скорости свыше 50000 событий в секунду превращается в рутинную процедуру, если использовать высокопроизводительный сортер клеток MoFlo. Этот мощный прибор позволяет ученым, занимающимся фундаментальными и клиническими исследованиями, ставить эксперименты, которые невозможно реализовать на других сортерах из-за их низкой скорости и необходимости вести сортировку в течение чрезвычайно длительного времени. При работе на MoFlo к характеристикам качества высокопроизводительной сортировки относят, помимо чистоты и выхода популяции, жизнеспособность и функциональную активность клеток. Приложения высокоскоростной сортировкиВысокоскоростная сортировка позволяет решать ряд практических задач; особенно связанных с выделением редких объектов, например специфических клеточных популяций. Ранее ученые пытались решать эти задачи, пользуясь проточными цитометрами в сочетании с другими технологиями выделения (сепарация с помощью магнитных частиц, проточная элютриация, разделение в градиентах плотности, комплемент-опосредованный лизис контаминирующих клеток и т.д.). Однако, использование этих технологий требует больших затрат времени и дополнительных манипуляций с клетками, которые могут отрицательно сказаться на функции клеток или вызвать их активацию. Высокоскоростная сортировка позволяет осуществлять одностадийную очистку, после чего нужная популяция (>99% чистоты) в кратчайшие сроки непосредственно переносится в культуру или пересаживается реципиенту. Использование MoFlo позволяет работать с несколькими популяциями клеток, выбрав соответствующие параметры, и одновременно собирать популяции (даже чрезвычайно редкие) в четыре отдельных термостатируемых приемника. Патентованная электроника DakoCytomation обрабатывает события с такой высокой скоростью, что искомая популяция клеток извлекается из первичного образца после однократного прохождения через сортер, без предварительного обогащения. В настоящее время растет интерес к высокоскоростной сортировке стволовых и дендритных клеток, предшественников T-клеток тимуса, а также генетических трансфектантов, частота которых в клеточной популяции менее 0.01%. Пользователь MoFlo может в рутинных условиях выделять популяции редких клеток, затрачивая на это меньше времени, чем требуется для подготовки к работе магнитной колонки. Дизайн прибораОсновной проблемой высокоскоростной сортировки является совмещение быстрой обработки событий и способности детектировать с высокой чувствительностью даже нечеткую флуоресценцию. Концентрация клеточного образца и работа при высоком давлении (обычно 60 фунтов на квадратный дюйм и выше) позволяют поддерживать диаметр потока, за счет чего осуществляется высокоточное измерение флуоресценции. Более того, высокое давление в сочетании с размерами наконечника определяет частоту стабильного формирования капель. Чем выше этот параметр, тем лучше выход, так как вероятность присутствия нескольких клеток в одной капле снижается. Поэтому число капель, выбраковывающихся из-за совпадения событий, уменьшается. Если сортеры традиционной конструкции обычно генерируют от 10 до 30 тысяч капель в секунду, для MoFlo этот показатель составляет 90-200 тыс.; за счет этого выход клеток любой сортируемой популяции возрастает без ухудшения чистоты сортировки. Чтобы перемещать клетки с такой высокой скоростью без возникновения турбулентности потока и потери ими жизнеспособности (или изменения их функциональных свойств), необходима особая гидравлическая система.
Высокие эксплуатационные качестваВ сортере MoFlo используются наконечники запатентованной конструкции, с помощью которых уменьшается турбулентность и сводятся к минимуму воздействия ускорений на каждый тип сортируемых клеток. Валидации данной конструкции посвящено большое число публикаций. В настоящее время MoFlo рутинно используется учеными многих стран мира для идентификации и сортировки широкого спектра клеток, в том числе T клеток, B клеток, NK клеток, гематопоэтических клеток (рис. 1) и нервных стволовых клеток. После сортировки все эти клетки полностью сохраняют свои функции (продукция цитокинов, презентация антигенов, синтез антител, активация, связывание с клетками мишенями, приживление в организме реципиента после трансплантации, длительный рост в культуре).
Flow Cytometry ReferencesResearchers around the world and across many scientific disciplines rely on the MoFlo® High-Performance Cell Sorter. A partial list of journal articles highlighting some of their cutting-edge science follows. High-Throughput Screening
Stem Cells
Информация для заказа
| |||||||||||||||
|
|
© ООО «Лабораторная Диагностика» info@LD.ru тел.: +7 495 369-20-43 |