Митохондриальный путь апоптоза
 Апоптоз – это генетически обусловленный процесс саморазрушения клеток в физиологических или патологических условиях. Он сопровождается рядом морфологических и биохимических изменений, включая пикноз, фрагментацию ДНК, ремоделирование клеточных мембран, образование апоптотических тел и так далее. Наконец, апоптотические клетки поглощаются макрофагами и умирают. Апоптоз - это нормальный процесс гибели клеток, включающий активацию генов, экспрессию и регуляцию, который направлен на адаптацию к ее внутренней и внешней среде. В течение всего процесса апоптоза плазматическая мембрана все еще остается неповрежденной и не вызывает утечки цитоплазмы или воспалительной реакции. Апоптоз – это генетически обусловленный процесс саморазрушения клеток в физиологических или патологических условиях. Он сопровождается рядом морфологических и биохимических изменений, включая пикноз, фрагментацию ДНК, ремоделирование клеточных мембран, образование апоптотических тел и так далее. Наконец, апоптотические клетки поглощаются макрофагами и умирают. Апоптоз - это нормальный процесс гибели клеток, включающий активацию генов, экспрессию и регуляцию, который направлен на адаптацию к ее внутренней и внешней среде. В течение всего процесса апоптоза плазматическая мембрана все еще остается неповрежденной и не вызывает утечки цитоплазмы или воспалительной реакции.
Пути
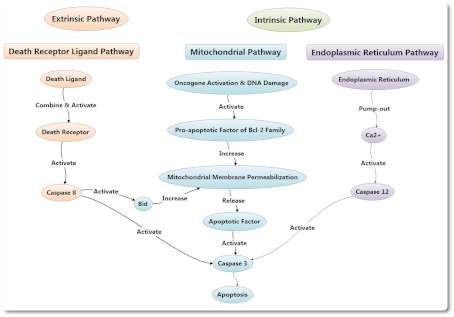 Пути апоптоза подразделяют на эндогенный митохондриальный путь, эндогенный эндоплазматический путь ретикулума и экзогенный путь рецептора смерти. Между тем, процесс апоптоза также может быть опосредован гранзимом В при определенных условиях. Пути апоптоза подразделяют на эндогенный митохондриальный путь, эндогенный эндоплазматический путь ретикулума и экзогенный путь рецептора смерти. Между тем, процесс апоптоза также может быть опосредован гранзимом В при определенных условиях.
Эндогенный митохондриальный путь
Эндогенный митохондриальный путь в клетках может быть активирован лигандом смерти (death ligand) или при стимулирующих факторах. Стимулирующие факторы включают активацию онкогенов, повреждение ДНК, гипоксию клеток, и так далее.
Семейство Bcl-2
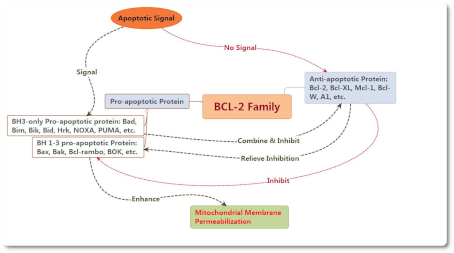
 Белки семейства BCL-2 являются регуляторами апоптоза, который состоит из антиапоптотических и проапоптотических членов и может контролировать апоптоз, управляя пермеабилизацией наружной мембраны митохондрий (mitochondrial outer membrane permeabilization MOMP). Проапоптотические белки можно разделить на BH1-3 и BH3. Белки семейства BCL-2 являются регуляторами апоптоза, который состоит из антиапоптотических и проапоптотических членов и может контролировать апоптоз, управляя пермеабилизацией наружной мембраны митохондрий (mitochondrial outer membrane permeabilization MOMP). Проапоптотические белки можно разделить на BH1-3 и BH3.
В настоящее время существует две гипотезы активированных путей Bax и Bak: прямой и косвенный.
Косвенный режим: обычно активность Bax и Bak ингибируется антиапоптотическим белком, поэтому он может быть активирован непосредственно, если антиапоптотическая активность была ингибирована членами семейства BH-3 только после получения апоптотического сигнала.
Прямой режим: BH3-only can be divided into activated protein and kinase protein. The activated protein which have not received apoptotic signal could combine with anti-apoptotic protein to inhibit the activation of Bax and Bak. In contrast, both Bax and Bak could be activated directly if kinase protein combines with anti-apoptotic protein to release activated protein as soon as receiving apoptotic signal.
Митохондриальный путь апоптоза
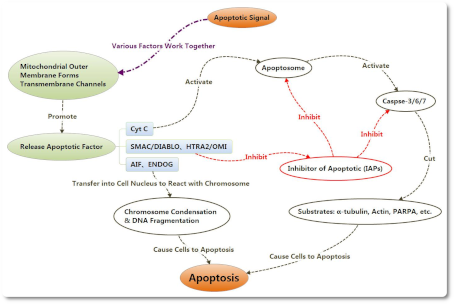 Снижение потенциала митохондриальной мембраны и повышение проницаемости мембраны могут вызвать высвобождение эндогенных митохондриальных апоптотических факторов, включая CytC, AIF, SMAC/DIABLO, HTRA2/OMI и ENDOG. Cyt C взаимодействует с Apaf-1 после высвобождения в клетки, образуя комплекс для апоптоза с помощью АТФ и dATP. Затем этот комплекс соединяется с Pro-Caspase 9, а также активирует его с образованием Caspase 9. Caspase 9 может вызвать дальнейшую активацию как Caspase 3, так и Caspase 7, чтобы начать каскадную реакцию каспаз и разрезать более 100 видов субстрата в клетках, таких как α-тубулин, актины, PARPA, ламин и т. д. Снижение потенциала митохондриальной мембраны и повышение проницаемости мембраны могут вызвать высвобождение эндогенных митохондриальных апоптотических факторов, включая CytC, AIF, SMAC/DIABLO, HTRA2/OMI и ENDOG. Cyt C взаимодействует с Apaf-1 после высвобождения в клетки, образуя комплекс для апоптоза с помощью АТФ и dATP. Затем этот комплекс соединяется с Pro-Caspase 9, а также активирует его с образованием Caspase 9. Caspase 9 может вызвать дальнейшую активацию как Caspase 3, так и Caspase 7, чтобы начать каскадную реакцию каспаз и разрезать более 100 видов субстрата в клетках, таких как α-тубулин, актины, PARPA, ламин и т. д.
Ингибиторы апоптоза могут подавлять активацию Caspase 3 и Caspase 7 для предотвращения клеточного апоптоза. После высвобождения из митохондрий в цитоплазму SMAC / DIABLO и HTRA2 / OMI могут объединяться с ингибиторами апоптоза, чтобы облегчить подавление апоптоза.
С изменением потенциала митохондриальной мембраны AIF и ENDOG также могут высвобождаться в цитоплазму, а затем переноситься в ядро клетки, чтобы вызвать конденсацию хромосом и фрагментацию ДНК, вызывая апоптоз.

| 
 Апоптоз – это генетически обусловленный процесс саморазрушения клеток в физиологических или патологических условиях. Он сопровождается рядом морфологических и биохимических изменений, включая пикноз, фрагментацию ДНК, ремоделирование клеточных мембран, образование апоптотических тел и так далее. Наконец, апоптотические клетки поглощаются макрофагами и умирают. Апоптоз - это нормальный процесс гибели клеток, включающий активацию генов, экспрессию и регуляцию, который направлен на адаптацию к ее внутренней и внешней среде. В течение всего процесса апоптоза плазматическая мембрана все еще остается неповрежденной и не вызывает утечки цитоплазмы или воспалительной реакции.
Апоптоз – это генетически обусловленный процесс саморазрушения клеток в физиологических или патологических условиях. Он сопровождается рядом морфологических и биохимических изменений, включая пикноз, фрагментацию ДНК, ремоделирование клеточных мембран, образование апоптотических тел и так далее. Наконец, апоптотические клетки поглощаются макрофагами и умирают. Апоптоз - это нормальный процесс гибели клеток, включающий активацию генов, экспрессию и регуляцию, который направлен на адаптацию к ее внутренней и внешней среде. В течение всего процесса апоптоза плазматическая мембрана все еще остается неповрежденной и не вызывает утечки цитоплазмы или воспалительной реакции. Пути апоптоза подразделяют на эндогенный митохондриальный путь, эндогенный эндоплазматический путь ретикулума и экзогенный путь рецептора смерти. Между тем, процесс апоптоза также может быть опосредован
Пути апоптоза подразделяют на эндогенный митохондриальный путь, эндогенный эндоплазматический путь ретикулума и экзогенный путь рецептора смерти. Между тем, процесс апоптоза также может быть опосредован  Белки семейства
Белки семейства 
 Снижение потенциала митохондриальной мембраны и повышение проницаемости мембраны могут вызвать высвобождение эндогенных митохондриальных апоптотических факторов, включая CytC, AIF, SMAC/DIABLO, HTRA2/OMI и ENDOG. Cyt C взаимодействует с Apaf-1 после высвобождения в клетки, образуя комплекс для апоптоза с помощью АТФ и dATP. Затем этот комплекс соединяется с Pro-Caspase 9, а также активирует его с образованием Caspase 9. Caspase 9 может вызвать дальнейшую активацию как Caspase 3, так и Caspase 7, чтобы начать каскадную реакцию каспаз и разрезать более 100 видов субстрата в клетках, таких как α-тубулин, актины, PARPA, ламин и т. д.
Снижение потенциала митохондриальной мембраны и повышение проницаемости мембраны могут вызвать высвобождение эндогенных митохондриальных апоптотических факторов, включая CytC, AIF, SMAC/DIABLO, HTRA2/OMI и ENDOG. Cyt C взаимодействует с Apaf-1 после высвобождения в клетки, образуя комплекс для апоптоза с помощью АТФ и dATP. Затем этот комплекс соединяется с Pro-Caspase 9, а также активирует его с образованием Caspase 9. Caspase 9 может вызвать дальнейшую активацию как Caspase 3, так и Caspase 7, чтобы начать каскадную реакцию каспаз и разрезать более 100 видов субстрата в клетках, таких как α-тубулин, актины, PARPA, ламин и т. д.