|
| ||||||
| |||||||
| / Каталог / Реагенты для научных исследований / Антитела | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
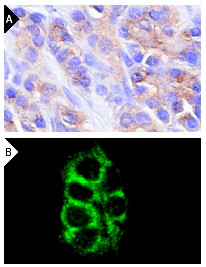
Антитела к супрессорам опухолей/ апоптозКомпания СантаКруз предлагает широкий выбор антител к супрессорам опухолей и апоптическим белкамp53
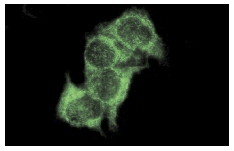
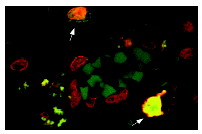
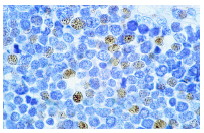
Широко известный и активно изучаемый ген p53 – супрессор опухолей содержит мутацию примерно в 50% клеток при раковых заболеваниях людей. Экспрессия белка p53 мала в нормальных клетках, но значительно возрастает в ответ на повреждение ДНК и сигналы бедствия клеток. Сверхэкспрессия фактора транскрипции p53 может индуцировать арест клеточного цикла и апоптоз, через регуляцию транскрипции некоторых генов, включая ингибитор клеточного цикла p21, ген репарации ДНК GADD45 и индуктор апоптоза Bax. Maspin
Маспин, ингибитор серин-протеазы млекопитающих (серпин), ингибирует подвижность, инвазию и метастаз клеток. Малпин расположен на поверхности клеток и перегородках в секреторных везикулах. В метастатических клетках рака груди линии MDA-MB-435, лечение рекомбинантным маспином увеличивает экспрессию интегрина α5 и интегрина α3 и снижает экспресиию интегрина α2, интегрина α4, интегрина α6, интегрина αV и интегрина β1. Считается, что подобные изменения уровня интегрина снижают инвазивные способности раковых клеток. p53-связывающие белкиГен – супрессор опухолей p53 видоизменен в 50% раковых клеток. Белки 53PB1 и 53BP2 (Bbp), связывающие белок p53, являются супрессорами опухолей, которые связываются с сайт-специфическим центральным ДНК-связывающим доменом p53 дикого типа конформационно-зависимым способом. Некоторые повреждения ДНК могут вызывать фосфорилирование p53 в серин 46. Это событие запускает экспрессию p53AIP1 (белок, индуцирующий апоптоз), который вносит вклад в последующие события, ведущие к программируемой клеточной смерти. PARC (цитоплазматический белок, ассоциированный с p53) действует как цитоплазматический якорь для p53 в клетках, не находящихся под воздействием стресса, таким образом, регулируя локализацию и последующую функцию p53. VDUP1Ген, кодирующий белок 1, активизирующий витамин D3 (VDUP1), активируется 1,25(OH)1D3 в ответ на различные стрессы, включая ROS, UV и тепловой шок. VDUP1 проявляет активность как супрессор опухолей путем индуцирования ареста фазы G0 / G1 клеточного цикла. Присутствие VDUP1 необходимо для экспрессии CD122 и созревания клеток естественных киллеров (NK), VDUP1 может быть использован в качестве лечебного фактора при лечении меланом.
p73 и p63 (p51/KET)p63 и p73, белки, высоко гомологичные p53, могут трансактивировать гены-мишени p53 и индуцировать апоптоз. p73 существует в 6 изоформах, α, β, γ, δ, ε и ξ, которые отличаются С-концами. Тем не менее, в отличие от p53, экспрессия p73 не активируется в ответ на повреждение ДНК. При сверхэкспресии p73 может активировать ген p21, реагирующий с p53. Ген p63 также кодирует многочисленные изоформы с разнообразными функциями. TA* p63α (также называемый p51B или KET), TA* p63β и TA* p63γ (также обозначенный p51A) содержат трансактивационные домены. ΔN изоформы p73 и p63 не содержат трансактивационного домена. AIF (apoptosis-inducing factor) и Fis1AIF (фактор, индуцирующий апоптоз) – это митохондриальный белок, который перемещается в ядро при индукции апоптоза. AIF индуцирует фрагментацию ДНК и конденсацию хроматина, а также освобождение цитохрома c и каспазы-9 из митохондрий. Сверхэкспрессия Bcl-2, белка, участвующего в проницаемости митохондрий, препятствует освобождению AIF из митохондрий. Fis1 также способствует фрагментации митохондриальной сети и кластеризации перинуклеарного пространства в процессе апоптоза. MDM2, MDMX и p53RFPMDM2 (murine double minute-2) – онкоген-кодируемый клеточный фосфопротеин, массой 90 kDa, связывается с p53 и таким образом блокирует p53-опосредованную трансактивацию. Ген MDM2 функционирует в значительном количестве человеческих сарком и в этих клетках сохраняется аллели p53 дикого типа, что позволяет предположить, что MDM2 может действовать путем нейтрализации функций p53 в процессе онкогенеза. MDM2-родственный протеин MDMX (MDM4) расположен на человеческой хромосоме 1q32 и является мишенью амплификации в злокачественных глиомах. MDMX ингибирует MDM2-опосредованную деградацию p53 посредством различных ассоциаций с MDM2. ARF взаимодействует с MDMX для изолирования MDMX внутри ядра, в результате чего возрастает трансактивация p53. p53-индуцируемый RING finger protein (p53RFP) – белок, действующий как E3 убиквитин лигаза. Эта лигаза освобождает убиквитин из специфических E2 убиквитин-конъюгированных ферментов и переносит их на субстраты, которые активизируют деградацию протеасом. Daxx
Daxx - основной белок, индуцирующий FAS-зависимый апоптоз. Хотя сам Daxx не содержит домен смерти, он специфически связывается с доменом смерти FAS. Сверхэкспрессия Daxx активирует JNK путь и усиливает FAS-зависимый апоптоз. Апоптический путь Daxx действует совместно с FAS-FADD-FLICE путем, но отличается от него по своей природе.
PTTGPTTG, белок гена трансформации опухоли гипофиза (также известный как секурин), - это белок с молекулярной массой 22 kDa. Этот белок - регулятор клеточного цикла содержит основной N-терминальный домен и кислый C-терминальный домен, который действует как трансактивационный домен при взаимодействии с гетероморфным ДНК-связывающим доменом. PTTG человека сверхэкспрессируется в лейкемических Т-клеточных линиях Jurkat, а также обнаружен в тимусе, семенниках и плаценте. PTTG локализован в цитоплазме и, частично, в ядре.
TDAG51TDAG51 кодирует белок, богатый пролином, гистидином и гултамином, который необходим для экспрессии FAS (CD95) и, таким образом, играет ключевую роль в активации апоптоза T-клеточных гибридом. TDAGG51 может играть значительную роль в индукции апоптоза путем стимуляции Т-клеточных рецепторов и индукции FAS. Семейство белков RbБелок чувствительности к ретинобластоме Rb - это фосфорилированный белок, молекулярной массой 110 kDa. Как и p53, Rb p110 является антионкогеном, который инактивируется или мутациями, или при связывании с некоторыми белками, кодирующими ДНК онкогенных вирусов. Rb связывается и регулирует факторы транскрипции, участвующие в регуляции клеточного цикла, включая семейство белков E2F. Два родственных Rb белка, p107 и p130, также действуют как регуляторы некоторых членов семейства факторов транскрипции E2F. Связывание и инактивация белков E2F Rb регулируется фосфорилированием циклин-зависимых киназ. Белки программируемой клеточной смертиPD-1 (программируемая клеточная смерть-1) - это трансмембранный рецептор типа I и член надсемейства иммуноглобулинов. Экспрессия PD-1 обнаружена в вилочковой железе мышей, она индуцируется в стимулированных линиях Т- и В-клеток, где белок PD-1 может принимать участие в негативной регуляции различных иммунных ответов. Помимо этого, в активированных лимфоцитах PD-1 опосредует активацию классического типа программируемой клеточной смерти. PD-2 (также называемый Pdcd-2, PDL-2, B7DC) сильно экспрессируется в клетках плаценты, сердца, поджелудочной железы, легких и печени, и слабо экспрессируется в селезенке, лимфоузлах и вилочковой железе. Pdcd-4 - это ядерный белок, локализованный в ядре пролиферирующих клеток. Экспрессия кодирующего гена модулируется цитокинами в нормальных клетках-киллерах (NK) и Т-клетках, и, как полагают, продукт гена играет роль в апоптозе клеток. ALG-2 (апоптоз-связанный ген-2, также называемый белком 6 запрограммированной клеточной смерти) - это Ca2+ - связанный белок, который принимает участие на поздних стадиях апоптоза.
КластеринКластерин (TRPM-2 (testosterone-repressed prostate message-2, сульфатированный гликопротеин-2) экспрессируется в различных тканях как дисульфид-связанный, гетеродимерный сульфатированный гликопротеин. Кластерин может принимать участие в транспорте липопротеинов, ингибировании комплементноопосредованного клеточного лизиса и модуляции межклеточных взаимодействий. Надсемейство лигандов фактора некроза опухолей
Программируемая клеточная смерть (апоптоз) вспомогательных клеток необходима для процессов эмбриогенеза, метаморфоза, обновления тканей, правильного развития и функционирования иммунной системы. Апоптоз сопровождается конденсацией хроматина, фрагментацией ядра, формированием мембранных пузырьков. Существует ряд белков, ответственных за баланс сигналов о смерти и/ или выживании клетки. Одними из таких белков являются белки из надсемейства лигандов фактора некроза опухолей, такие как FAS (APO-1, CD95), лиганд FAS (FAS-L, APO-1L, CD178), TRAIL и TWEAK (APO3L) и FAF-1 (фактор-1, ассоциированный с FAS). Ген апоптозного ответа простаты 4Ген апоптозного ответа простаты 4 (PAR4) - это протеин весом 38 kDa с сигналом ядерной локализации и лейциновым зиппером на С-конце. RAP4 экспрессируется в апоптических клетках, но не индуцируется стимуляцией фактора роста, окислительным стрессом, некрозом или остановкой роста. Гранзимы
Семейство гранзимов принадлежит к семейству пептидаз S1. Гранзим A и гранзим В - это сериновые протеазы, которые проводят апоптические сигналы в цитотоксических Т-лимфоцитах (CTL) и нормальных клетках-киллерах (NK). Внутри гранул активированных цитотоксических Т-лимфоцитов, гранзим А и гранзим В преобразуются в их активную форму с помощью лизосомальной цистеин протеазы катепсина С. Однажды расщепленные, эти активные протеазы опосредуют апоптоз двумя различными путями. Гранзим H, локализованный в цитотоксических гранулах цитолитических Т-лимфоцитов, необходим для лизиса клеток-мишеней при иммунном клеточном ответе. Гранзим K - это сериновая протеаза, локализованная в гранулах нормальных клеток-киллеров (NK) и цитотоксических Т-лимфоцитах. Гранзим М, найденный в нормальных клетках-киллерах, участвует в смерти клеток-мишеней, инициированной токсическими лимфоцитами. Сигнальные интермедиаторы с доменом смерти
Домен смерти, цитоплазматический домен, включающий примерно 80 аминокислот, необходим для трансдукции апоптических сигналов и представлен в таких апоптоз-опосредующих рецепторах, как TNF-R1 и FAS. Другие содержащие домен смерти, но структурно неродственные белки, были идентифицированы на основе их способности связываться с цитоплазматическими доменами TNF-R1 и FAS. Этот ряд белков включает FADD, TRADD, RAIDD, PIDD, RICK, RIP, RIP-2, RIP-3, Siva, DAP-1, DAP-3, DAP-5 и DEDD. Bcl10
Bcl10 - это регуляторный белок апоптоза, содержащий CARD - домен активации и рекрутирования каспаз. Первый, вовлеченный в образование злокачественных опухолей, CARD-содержащий белок Bcl10 сильно восприимчив к мутациям. Одна из мутаций приводит к потере Bcl10 проапоптозных функций и задержке активации NFkB. Аномалии Bcl10 представлены в фолликулярных лимфомах и мезотелиомах. Про-/ антиапоптические белки Bcl-2/ Bax и родственные протеины
Семейство белков Bcl-2 регулирует апоптоз и передачу сигналов смерти к митохондриям. Это семейство белков включает как про-, так и антиапоптические белки, которые обладают гомологичными Bcl-2 последовательностями (BH1-4). Белки BH3, BID, NOXA, PUMA, BIK, BIM и BAD являются проапоптическими белками и несут последовательность, гомологичную альфа-спиральному региону BH3. Ген PUMA кодирует четыре белка, PUMAα, β, γ и δ. PUMAα и PUMAβ содержат домен BH3, в то время как PUMAγ и PUMAδ нет. Другие проапоптические члены семейства включают Bax, Bcl-xS, Bak, NBK (Bik), Hrk, Bok, Noxa, Diva и BMF. Ингибиторы апоптоза включают Bcl-2, Bcl-xL, Bcl-xb, Bcl-xg, Bcl-w, Mcl-1, Bag-1, A1 (Bfl-1), BAR и Bl-1 (TEGT). Bax представлен многочисленными сплайсинговыми вариантами, такими как α, β, γ, δ и κ. Bax-β - это белок молекулярной массой 24 kDa, состоящий из 218 аминокислот. BECN1 (Bectin1) - бивалентный белок, ингибитор онкогенеза. BECN1 играет важную роль в аутофагии. CASCAS (ген клеточной апоптической чувствительности) - это гомолог CSE1 у дрожжей. CAS, белок, молекулярной массой 100 kDa, сильно экспрессируется в активно делящихся клетках. Экспрессия CAS возрастает, когда покоящиеся человеческие фибробласты начинают пролиферировать и уменьшается, когда происходит арест роста. CAS играет важную роль в токсическом некрозе и некрозе опухолей и пролиферации клеток. ТрансглутаминазаСемейство трансглутаминаз (TGase), которое включает TGase1, TGase2 и TGase3, - это внутриклеточные Ca2+ - зависимые ферменты, которые катализируют формирование изопептидных связей путем переноса амина на остатки глутамина, таким образом, сшивая остатки глутамина и остатки лизина с образованием субстратных белков. Трансглутаминазы участвуют в разнообразных процессах, включая свертывание крови, дифференциацию эпидермиса, коагуляцию спермы и сингамию, дифференциацию клеток и апоптоз. Цистеиновые протеазы (каспазы)Протеазы - это ферменты, расщепляющие белки. Цистеиновые протеазы имеют характерный каталитический триадный механизм. Первый шаг - это депротонирование тиола на активный сайт энзима с помощью прилежащей аминокислоты с основной боковой цепью. Затем анион серы с депротонированного цистеина нуклеофильно атакует углерод субстрата. Фрагмент субстрата с аминным концом высвобождается и формируется новый углеродный конец субстрата, связанный с цистеином посредством тиоэфира. Тиоэфирная связь затем гидролизуется с формированием на фрагменте молекул карбоновой кислоты, вследствие чего происходит регенерация свободный энзимов. Каспазы - это пример цистеиновых протеаз, необходимых клеткам для апоптоза. Некоторые каспазы также необходимы иммунной системе для созревания цитокинов. Субстраты цистеиновых протеаз
Ced/ICE или семейство каспаз (цистеиновых протеаз) играет основную роль в проведении апоптоза путем протеолиза специфических мишеней. Среди таких мишеней: поли (АДФ-рибоза) полимераза (PARP), гельсолин, ядерные ламины. PARP - это ядерный белок, молекулярной массой 112 kDa, который специфично расщепляется каспазой-3 и каспазой-6, но не каспазой-1 с образованием апоптического фрагмента, молекулярной массой 85 kDa. PARP-2 и PARP-3 взаимодействуют с PARP-1. PARP ассоциируется с MVP (major vault protein) и TEP1 (telomerase-associated protein 1) для формирования камер, бочковидных цитоплазматических рибонуклеопротеиновых частиц. PARP-10 принимает участие в пролиферации клеток. Он локализуется в ядре и цитоплазматических компарментах, где он ингибирует ко-трансформацию c-Myc- и E1A фибробластов. Гельсолин расщепляется каспазой-3 с образованием активной формы, которая расщепляет филаменты актина. Ядерные ламины необходимы для поддержания целостности ядерной оболочки и клеточной морфологии. Ядерный ламин А, молекулярной массой 70 kDa, расщепляется каспазой-6, но не каспазой-3. Для полной конденсации хромосомальной ДНК необходимо расщепление ламина А. Ламин С - это сплайсинговый вариант ламина А. Ядерный ламин В фрагментируется в процессе апоптоза каспазой-6. Белки, взаимодействующие с TRAFБелки, взаимодействующие с TRAF (белок-рецептор фактора некроза), включают TANK, ILP, ML-IAP, c-IAP1, XAF1, ILPIP, c-IAP, бореалин и сурвивин. TANK связывается с консервативным доменом TRAF-C, общим для TRAF1, TRAF2 и TRAF3. ML-IAP, c-IAP1, c-IAP2 родственные белки апоптическим белкам семейства IAP бакуловируса. ILP ингибирует активированную каспазу-3, что приводит к устойчивости к FAS-опосредованному апоптозу. ILPIP (белок, взаимодействующий с IAP) значительно усиливает XAF1-опосредованную активацию белков семейства JNK. Сурвивин (TIAP) экспрессируется во время фаз G2/M клеточного цикла и ассоциирован с микротрубочками митотического веретена. Активность каспазы-3 возрастает при разрушении ассоциации сурвивин-микротрубочки. Снижение уровня бореалина посредством РНК-интерференции (RNAi) приводит к разрушению соедиения кинетохор-веретено, задержке митотического процесса и нарушению распределения хромосом в анафазе путем формирования биполярных веретен. tsg101Ген опухолевой чувствительности 101 (tsg101) кодирует белок, содержащий домен связывания со статмином, который принимает участие в различных клеточных функциях, включая формирование митотического веретена деления, стабилизации генома, трансактивацию транскрипции и регулирование уровня MDM2 и p53. Белок весом 46 kDa собирается в высокомолекулярный комплекс (ESCRT-1), который принимает участие в формировании эндосом. Инактивация гена tsg101 в фибробластах мышей приводит к трансформации клеток и формированию метастаз. Сверхэкспрессия N-концевого региона tsg101 заметно ингибирует формирование частиц HIV-1. Внутриклеточная локализация tsg101 варьирует в зависимости от стадии клеточного цикла. Регуляторный белок KuБелок Ku, который изначально был описан как аутоиммунный антиген, распознаваемый антителами больных ревматизмом, - это гетеродимерный комплекс, состоящий из субъединиц, молекулярной массой 70 и 86 kDa. Показано, что Ku несет функцию ДНК-связывающего компонента ДНК-зависимой серин-треонин киназы (DNA-PK). Цитохром c и b
Цитохром с - широко известный белок, участвующий в транспорте свободных электронов, важнейшем процессе преобразования энергии у всех аэробных организмов. В клетках млекопитающих этот высоко консервативный белок в норме локализован в межмембранном пространстве. Цитоплазматический цитохром с - фактор, необходимый для активации апоптоза. В процессе апоптоза цитохром с перемещается из трансмембранного пространства в цитозоль, где он необходим для активации каспазы-3 (CPP32). Перемещение цитохрома с может быть блокировано сверхэкспрессией Bcl-2. Цитохром b вместе с цитохромом c1 и белком Риске формируют комплекс III, который участвует в клеточном дыхании. Белки репарации двуцепочечных разрывов ДНКБелки репарации ДНК Rad50, Rad51A-D, Rad52 и Rad54A и B являются ключевыми белками репарации двуцепочечных разрывов ДНК (DSBR). Spo11, Rad50, Rad51A-D, Rad52, Rad54A и B важны для митотической и мейотической рекомбинации. Дополнительные белки, вовлеченные в процесс DSBR, включают XRCC1-4, DMC1, нибрин, APNG, MRE11, HR23A, HR23B, Rad23, PRP19, ДНК лигазу I, ДНК лигазу IV и DNAPK. ДНК лигаза - это тип лигаз, которые соединяют нити ДНК, имеющие двунитевые разрывы, функционирующий как при репарации, так и при репликации ДНК. Rad21 - одна из основных субъединиц когезина, который удерживает сестринские хромосомы вместе в течение анафазы, это каспаза-подобный фермент, обеспечивающий процесс сепарации хромосом. Белки семейства ACP
Аденоматический полипоз, семейный аденоматозный полипоз (FAP), синдром Гарднера (GS) характеризуются многочисленными аденоматозными полипами по всей длине толстой кишки и неизменно развиваются в рак толстой кишки. Ген APC кодирует повсеместно экспрессируемый белок, молекулярной массой 300 kDa, который часто подвергается мутациям у больных FAP и GS. APC ассоциированы со структурными компонентами межклеточных соединений и конкурируют с E-кадгерином за связывание специфических регионов бета- и гамма-катенина. Как и APC, APC2 содержит домен SAMP, который необходим для связывания кондактина. APC и APC2 регулируют формирование активных бета-катенин-Tcf комплексов. ICAD, CAD и CIDE белки
Фактор фрагментации ДНК (DFF) играет роль в апоптозе с участием каспазы-3. DFF состоит из двух субъединиц: CAP (апоптозная ДНКаза) и ICAD (ингибитор CAD) весом 45 kDa. CAD - это ДНКаза, ответственная за деградацию ДНК в процессе апоптоза. ICAD функционирует в качестве регуляторной единицы, которая ингибирует активность CAD. Каспаза-3 расщепляет ICAD, оставшийся после расщепления С-концевой фрагмент ICAD весом 11 kDa позволяет CAD высвободиться, после чего CAD проникает в ядро для разрушения ДНК. CIDE-A и CIDE-B идентифицированы как белки, имеющие гомологию с N-концевым регионом ICAD. Так же, как и CAD, CIDE-A и CIDE-B являются проапоптическими белками, разрушают ДНК и ингибируются ICAD. BRCA1 и BRCA2Ген чувствительности к раку груди, BRCA1, который локализован на хромосоме 17q, экспрессируется в различных тканях, включая грудь и яичники. Второй ген чувствительности к раку груди, BRCA2, локализован на хромосоме 13q12-13, также значительно влияет на развитие рака груди и яичников. Семейство GADD (арест роста и повреждение ДНК)GADD45 стимулирует эксцизионную репарацию ДНК in vitro, ингибирует переход клеток в фазу S и, совместно с GADD 153 и GADD34, индуцирует арест роста. GADD 153 также индуцируется при повреждениях ДНК, но, в отличие от GADD45, индукция не зависит от p53. GADD45-подобные белки, GADD45β и GADD45γ, индуцируются при стрессе, вызванной окружающей средой. PA26, еще один родственный GADD ген, является возможной мишенью p53 и экспрессируется в трех различных изоформах. Нейрофиброматозные белки типов 1 и 2
Нейрофиброматоз типа 1 (NF1) или нейрофиброматоз Реклингхаузена - одна из наиболее распространенных аутосомных доминантных болезней у людей. Транскрипт NF1 кодирует белок нейрофибромин (NF1GRP), молекулярной массой 220 kDa, который обильно экспрессируется в нервной системе. Нейрофибромин может участвовать в развитии васкулярного нейрофиброматоза, аутосомного доминантного заболевания. Нейрофиброматоз типа 2 (NF2) - это доминантно наследуемое заболевание, которое сопровождается развитием двусторонней вестибулярной невриномы и других раковых заболеваний центральной нервной системы. PTEN, DMBT1 и LCI1Ген - супрессор опухолей PTEN (протеин тирозин фосфатаза), DMBT1 (делеция генов в злокачественных опухолях мозга), LGI1 (богатый лейцином, инактивированный в глиоме ген) были изолированы из участка хромосомы 10, для которой характерно высокая частота делеций в большинстве человеческих глиом. Ген PTEN также мутирован при других раковых заболеваниях, включая рак мозга, груди, почек и простаты. PTEN - это протеин тирозин фосфатаза, локализованная в цитоплазме и обладающая сходной морфологией с цитоскелетными белками тенсином и ауксилином. Пониженная экспрессия DMBT1 обнаружена при раке желудочно-кишечного тракта и раке пищевода, а также в глиомах. LGI1 обладает сходной морфологией с некоторыми трансмембранными и экстрацеллюлярными белками, которые функционируют как рецепторы и адгезивные белки. Белки репарации ошибочных оснований ДНКМутации в генах репарации ошибочных оснований ДНК, которые представлены MSH2, MSH3, MSH6, MLH1, MLH3, PMS1, PMS2, Exo1, GTBP, MYH и MGMT связаны с наследственным неполипозным раком прямой кишки (HNPCC). Наследственные мутации в генах MSH2 и MLH1 происходят с высокой частотой при HNPCC и связаны с нестабильностью микросателлитов. При 10 - 45% раковых заболеваниях поджелудочной железы, желудка, груди, яичников, мелкоклеточном раке легких также наблюдается нестабильность микросателлитов, что позволяет предположить, что репарация ошибочных оснований ДНК не ограничена HNPCC, но является общей чертой при образовании и разрастании опухолей. GTBP (G/T - связывающий белок) совместно с MSH2 распознает ошибочные основания ДНК. Раково-тестикулярные антигены
Раково-тестикулярные антигены (CTAG) - это семейство белков, которое включает изоформы MAGE-A, MAGE-B, GAGE, NRAGE, PRAME, PRAME like-1, BAGE, LAGE-1, XAGE-1, Ndn и NY-ESO. Белки этого семейства экспрессируются в нормальных тканях и множестве линий раковых клеток. Антигены CT, принадлежащие к обширной группе антигенов рака человека, распознаемых цитолитическими Т-лимфоцитами (CTLs), могут выполнять роль маркеров меланом. Более того, белки CTAG являются потенциальными мишенями противораковой иммунотерапии из-за их раково-специфической экспрессии. Белки-супрессоры опухолей/ элонгин (SIII)Генеративная мутация в гене-супрессоре болезни Гиппеля-Линдау провоцирует развитие различных типов раковых заболеваний, включая гипернефрому, гемангиобластому центральной нервной системы и феохромоцитому. Элонгин (SIII), гетеродимерный клеточный фактор транскрипции состоит из транскрипционно-активной субъединицы (А) и двух регуляторных субъединиц (B и С), активирует элонгацию транскрипции РНК-полимеразой II и является функциональной мишенью белков VHL Галектины
Галектины - это семейство растворимых, бета-галактозид-связывающих животных лектинов, которые регулируют межклеточную адгезию и взаимодействие клеток с межклеточным матриксом. Они также участвуют в развитии рака, пре-мРНК сплайсинге и апоптозе. Хотя механизм действия галектинов до конца еще не изучен, их роль может состоять в связывании N-ацетиллактозамин-содержащих структур, найденных на поверхности клеток и в экстрацеллюлярном матриксе. Информация для заказа
|
|
|
© ООО «Лабораторная Диагностика» info@LD.ru тел.: +7 495 369-20-43 |